安全性評価ソリューション(株)は不必要な試験費用を減らすため、最新の国内外の動向を把握し、
これを反映して試験を省略·代替できる根拠資料を用意するお手伝いをしています
これを反映して試験を省略·代替できる根拠資料を用意するお手伝いをしています
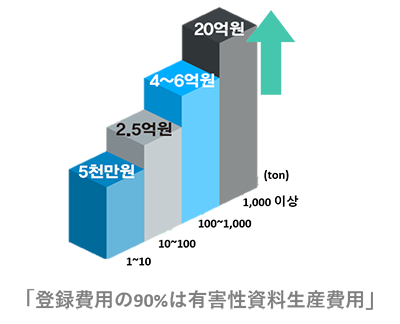
- 規制対応登録に必要な有害性試験資料の生産には莫大な費用及び時間がかかります。
-
登録資料として活用できるRead-AcrossおよびQSAR資料提出サービス
(根拠:K-REACH(化学物質登録および評価に関する法律)
第14条および施行令13条第3号) - 実際の試験資料の代わりにin silico資料を生産·提出することで、
- 規制対応有害性費用の生産節減 (約30%)
- 企業の新物質開発に役立ちます。 - 実際に試験物質がなくても、構造式だけで資料を生産
- 物質合成前のスクリーニング、精製困難な物質に対する事前評価などに有用
QSAR & Read across
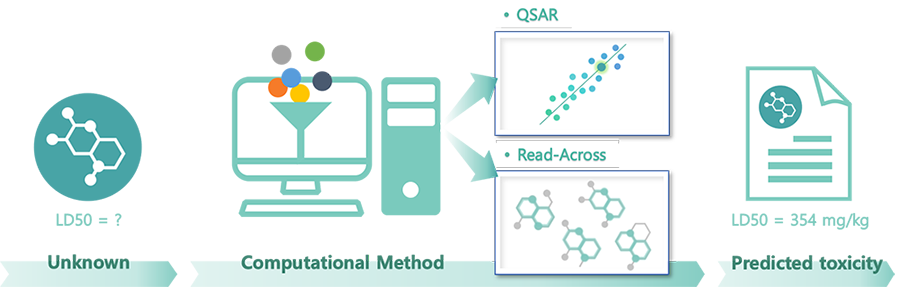


Read-Acrossに類似しているが既存物質資料から化学構造と特性との関係を数学的にモデル化し、
希望する物質に適用することで新しい予測資料を算出する in silico 代替試験法です。
これに対する研究も世界的に活発に行われています。
人の健康や環境の有害性を判断できる化学物質。”
- K-REACH 施行令13条第3号

試験資料のない化学物質と構造が類似した多数の物質の物性、或いは既存毒性資料を活用して、
毒性と構造の相関性(上記前提)を立証するもので、 試験資料のない化学物質の毒性資料として活用することができます。
QSAR(非試験資料)の活用
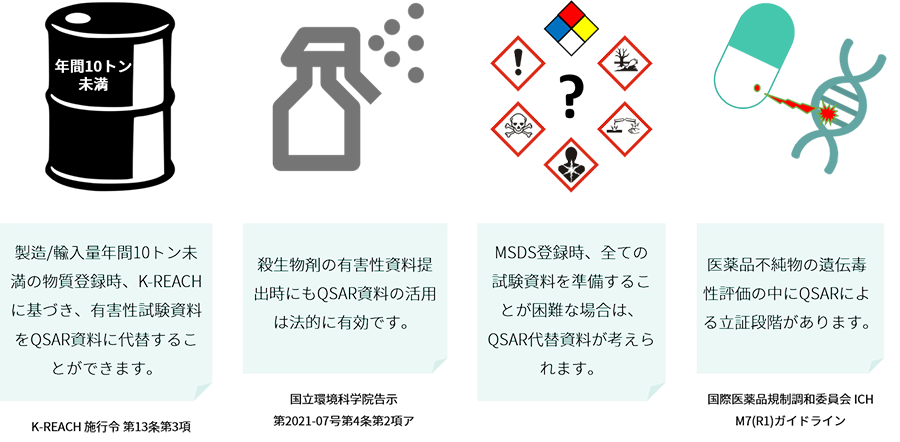
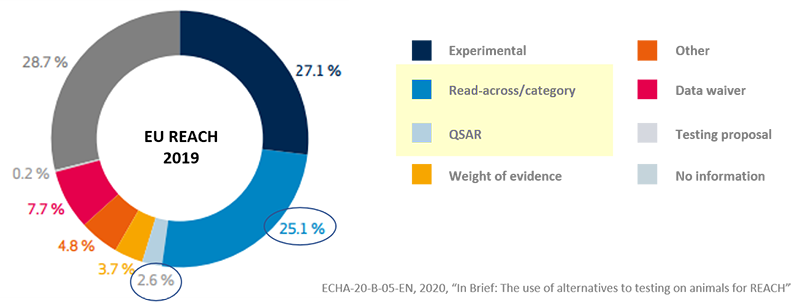
ヨーロッパ、 4件に1件以上を試験代替資料として登録